Приборы и методы определения активной кислотности (рн) продовольственных товаров
Активная кислотность характеризуется концентрацией свободных ионов водорода в растворе. Значение рН определяют как отрицательный логарифм концентрации ионов водорода.
Величина рН характеризует качество большинства пищевых продуктов, этот показатель можно применять для контроля биохимических процессов, происходящих при переработке и хранении пищевых продуктов. Кроме того, с активной кислотностью среды теснейшим образом связана жизнедеятельность микроорганизмов.
Концентрацию водородных ионов можно определить по потенциалу (потенциометрический метод), который возникает на границе различных электродов, помещенных в исследуемый раствор. При погружении электрода в раствор на границе электрод — раствор возникает электрический потенциал, так как ионы электрода переходят в раствор. При этом электрод (металл) заряжается положительно, а пограничный слой раствора — отрицательно.
Возникающие пограничные потенциалы функционально связаны с активной концентрацией ионов водорода. Однако технически можно измерить лишь разность потенциалов. Поэтому прибор для измерения рН состоит из двух полуэлементов или электродов: потенциал одного из них прямо или косвенно зависит от концентрации определяемых ионов — его называют индикаторным электродом; и второй электрод, относительно которого измеряется потенциал индикаторного электрода, — называется электродом сравнения.
При помощи рН-метра измеряют разность потенциалов между двумя электродами, помещенными в раствор. Основой такой системы служит электрод, потенциал которого зависит от рН. Чаще всего в качестве такой рН-зависимой ячейки используют стеклянный электрод, принцип действия которого основан на том, что некоторые типы боросиликатно-го стекла проницаемы для ионов Н+, но непроницаемы для любых других катионов или анионов. Если тонкий слой такого стекла поместить между двумя растворами с различными концентрациями ионов Н+, эти ионы будут диффундировать сквозь стекло из раствора с высокой концентрацией ионов водорода в раствор с низкой концентрацией. Стеклянный электрод содержит 0,1-молярный раствор соляной кислоты в кон-
такте со стеклом, проницаемым для Н+-ионов. К измерительному прибору его присоединяют проволокой, покрытой хлоридом серебра и погруженной в соляную кислоту (рис. 5.1).
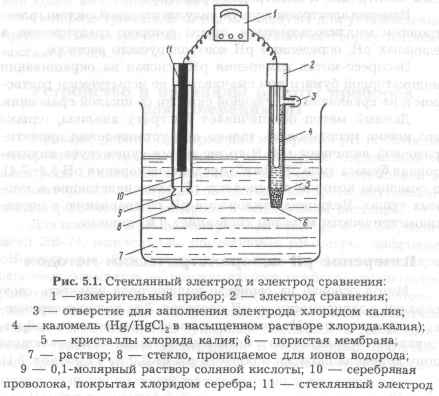
Цепь замыкается при погружении в раствор электрода сравнения, который чаще всего содержит пасту Hg/HgCl2 в насыщенном растворе хлорида калия. Хлорид калия служит для создания контакта между Hg/HgCl2 — полуэлементом и раствором, в котором проводят измерение.
Такой полуэлемент помещают в стеклянный корпус, непроницаемый для Н+-ионов (его потенциал не зависит от рН). Электрический контакт между раствором хлорида калия внутри электрода сравнения и измеряемым раствором осуществ
ляется с помощью тонкой нити или капилляра в стеклянном корпусе. Напряжение, измеряемое такой системой, является, прежде всего, разностью потенциалов между стеклянным электродом и электродом сравнения.
Измеряя электродвижущую силу электродной системы электронным милливольтметром, шкала которого градуирована в единицах рН, определяют рН контролируемого раствора.
Экспресс-метод измерения рН основан на окрашивании индикаторной бумаги при смачивании ее испытуемым раствором и на сравнении полученной окраски со шкалой сравнения.
Данный метод обеспечивает быстроту анализа, однако его можно использовать только для установления ориентировочной величины рН. В то же время существует индикаторная бумага типа "Рифан" (пределы измерения рН 5,8-7,4), с помощью которой определяют рН непосредственно в мясных тушах. Величина отклонения рН по сравнению с потен-циометрическим методом составляет 0,4 единицы.
Измерение рН колориметрическим методом
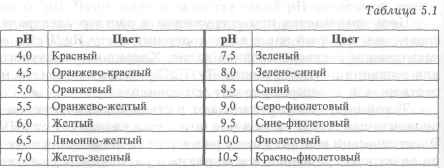
Метод основан на свойстве индикаторов изменять свою окраску в зависимости от рН раствора. Для колориметрического определения рН можно использовать универсальный индикатор, состоящий из смеси индикаторов, охватывающих зону перехода окраски в области рН от 3,0 до 11,0 (табл. 5.1).
Универсальный индикатор представляет собой смесь, состоящую из 0,1 г метилового красного, 0,2 г бромтимолового синего, 0,4 г фенолфталеина и растворенную в этаноле в мерной колбе вместимостью 500 см3.
Колориметрический метод используют для установления приближенного значения рН неизвестного раствора с погрешностью 1,0-0,5.